Los patógenos de
artrópodos incluyen hongos, bacterias, virus, nemátodos y protozoarios. Los
protozoarios, sin embargo, han tenido poca importancia en control biológico,
siendo principalmente debilitadores más que letales para sus hospederos. Los
microsporidios, anteriormente considerados protozoarios y ahora ubicados
taxonómicamente con los hongos, tienen importancia relevante como agentes de
control biológico clásico pero existe preocupación por el posible daño por
infecciones a colonias de agentes de control biológico de artrópodos.
Los patógenos son una
parte importante del control natural. Epizootias espontáneas de patógenos
ocurren a veces en las poblaciones de plagas (Fuxa y Tanada, 1987) como, por ejemplo,
las epidemias virales y fungosas que periódicamente diezman las larvas de la
polilla gitana Lymatria dispar (L.)
en Norteamérica (Gillock y Hain, 2001/2002). El uso de patógenos en control
biológico clásico o aumentativo inoculativo ha incluido programas contra el
escarabajo rinoceronte Oryctes rhinoceros
(L.) en cocoteros de islas del Pacífico por un virus introducido de Oryctes, el control de la mosca sierra
de la picea Gilpinia hercyniae (Hartig)
en Canadá por un baculovirus, y el de la avispa de la madera Sirex por el nemátodo Deladenus (Beddingia) siricidicola (Bedding) en Australia.
Aunque aún son escasos, los casos en que los patógenos de artrópodos son
utilizados en control biológico clásico pueden incrementarse en el futuro.
La mayoría de la
investigación sobre el uso de patógenos para control biológico, sin embargo, se
ha enfocado en formular microrganismos para aplicación específica del sitio
como bioplaguicidas (Cherwonogrodzky, 1980; Federici, 1999, 2007). Aquí se
considera la biología de los grupos de patógenos más importantes y los factores
que afectan su dinámica de transmisión en el control natural.
Hongos entomopatógenos
Los hongos pueden ser agentes del control
biológico clásico, bioplaguicidas o parte del control natural a través de las
epidemias que periódicamente causan en algunos artrópodos (Goh et al., 1989; Carruthers y Hural, 1990). Los hongos
tienen poca importancia en el control biológico por conservación porque las
manipulaciones para crear epidemias por hongos, con demanda en localidades
específicas, generalmente no son prácticas o no están disponibles.
Los casos exitosos de control biológico
clásico de insectos usando hongos introducidos han sido pocos. El hongo Zoophthora radicans (Brefeld) Batko de Israel fue introducido
en Australia para ayudar en la supresión del áfido Therioaphis
trifolii (Monell) f. maculata (Milner et al., 1982). La introducción accidental del hongo asiático Entomophaga
maimaiga Humber,
Shimazu & Soper en el noreste de los Estados Unidos causó alta mortalidad
de las larvas de la polilla gitana (Webb et al., 1999) y se
cree que ha mantenido a la plaga bajo control, al menos en Nueva Inglaterra
(EU), desde 1990.
La mayoría de la investigación con hongos
como agentes del control biológico se ha enfocado en los esfuerzos para
desarrollarlos como bioplaguicidas (Ferron, 1978; Gillespie, 1988; Bateman and
Chapple., 2001; Bateman, 2004). El desarrollo exitoso de micoinsecticidas ha
sido frustrado por los rangos estrechos de hospederos y por la pobre
germinación de las conidias después de la aplicación (Moore y Prior, 1993). Un
producto para controlar a la langosta africana del desierto Schistocerca
gregaria Forskal y a
otros saltamontes plaga ha sido desarrollado basado en Metarhizium
flavoviride Gams (= M. anisopliae var. acridum). Este
producto ha sido promovido por grupos de ayuda internacional como una solución
ambientalmente más segura para controlar langostas en África; también ha sido
probado en Asia y Suramérica con altos niveles de mortalidad de saltamontes en
pruebas de campo (Li et al., 2000;
Magalhães et al., 2000;
Zhang et al., 2000). Una
especie australiana de Metarhizium (Green
Guard®) está registrada actualmente para usarla en Australia contra langostas
(Lawrence, 2006).
En algunos casos, los micoplaguicidas
aplicados actúan como agentes de control biológico clásico, reproduciéndose a
niveles suficientemente altos para continuar causando mortalidad a niveles
significativos por varios años, sin tener que repetir la aplicación. Éste es el
caso, por ejemplo, con Beauveria brongniartii (Saccardo) Petch, el cual fue aplicado en
pastizales y huertos de Suiza para controlar al escarabajo Melolontha
melolontha L. Este hongo
ha sido detectado en el suelo 14 años después de la aplicación (Enkerli et al., 2004), por lo que se creyó que contribuyó
al éxito del producto en el control de la plaga (Zelger, 1996).
Más de 400 especies de hongos que
infectan insectos han sido reconocidas (Hall y Papierok, 1982). Su taxonomía
está incluida en Brady (1981) y McCoy et al. (1988)
mientras que su biología, patología y uso en control de plagas es discutida en
Steinhaus (1963), Müller-Kögler (1965), Ferron (1978), Burges (1981a), McCoy et al. (1988), Tanada and Kaya (1993) y Khetan
(2001). La mayoría de la atención se ha enfocado alrededor de 20 especies
(Zimmermann, 1986) de 12 géneros (Roberts y Wraight, 1986). Incluyen a Lagenidium (considerado
ahora no un hongo verdadero sino un miembro del Reino Straminipila), Entomophaga, Neozygites, Entomophthora, Erynia,
Aschersonia, Verticillium, Nomuraea,
Hirsutella, Metarhizium, Beauveria y Paecilomyces (hongos verdaderos, del Reino Eumycota).
Lagenidium (REINO STRAMINIPILA)
Los miembros de este género infectan larvas de mosquitos y no requieren de un hospedero alternante para completar su ciclo de vida. Lagenidium giganteum Couch está registrado como un producto de control de plagas en los Estados Unidos.
Lagenidium
Control de insectos-plaga en la agricultura utilizando hongos entomopatogenos: retos y perspectivas
Beauveria bassiana
Metarhizium anissopliae
Senasica
Lagenidium (REINO STRAMINIPILA)
Los miembros de este género infectan larvas de mosquitos y no requieren de un hospedero alternante para completar su ciclo de vida. Lagenidium giganteum Couch está registrado como un producto de control de plagas en los Estados Unidos.
Lagenidium
Control de insectos-plaga en la agricultura utilizando hongos entomopatogenos: retos y perspectivas
Beauveria bassiana
Metarhizium anissopliae
Senasica
Bacterias entomopatógenas
De los varios grupos de patógenos, las bacterias son las que han
tenido más éxito en su uso comercial. Las bacterias sirven para este uso porque
varias especies importantes pueden crecer en medios de fermentación y no
requieren de métodos caros de cultivo. El mayor énfasis lo ha tenido Bacillus thuringiensis Berliner, la cual
tiene al menos 65 subespecies y muchos miles de aislamientos. Bacillus thuringiensis es un complejo de
subespecies que comúnmente se encuentra en hábitats como suelo, hojarasca,
heces de insectos y dentro de intestinos de insectos (Federici, 2007). Algunos
productos de B. thuringiensis contienen
bacterias vivas y proteínas tóxicas asociadas. El interés en B. thuringiensis, combinado con
desarrollos en biología molecular, condujo a la producción de cultivos
transgénicos (especialmente algodón y maíz) que expresan suficientes toxinas
Bt para proteger a las plantas de las plagas clave. Mientras las bacterias como
bioplaguicidas han permanecido como productos locales, las plantas transgénicas
Bt han transformado el control de plagas en algunos cultivos.
Aunque muchas especies de bacterias pueden causar enfermedades en
artrópodos, las que no forman esporas latentes (como las especies de Pseudomonas, Aerobacter, Cloaca o Serratia),
usualmente causan la enfermedad sólo cuando el hospedero está fisiológicamente
estresado. Sin embargo, una especie – Serratia
entomophila Grimmont, Jackson, Ageron & Noonan, el agente causante de
la enfermedad ámbar – ha sido desarrollado como bioplaguicida y es vendido en
Nueva Zelanda para el control del escarabajo plaga de los pastos Costelytra
zealandica (White), bajo el nombre de Invade (Jackson, 1990). Las formulaciones
granulares de esta bacteria permanecen activas en suelos inoculados hasta por
cinco meses (O’Callaghan y Gerard, 2005).
Las bacterias que forman esporas pueden infectar más fácilmente a
hospederos sanos, después de la ingestión de esporas. Especies como B. thuringiensis, Bacillus sphaericus Neide
y Paenibacillus popilliae (Dutky)
(antes en Bacillus [Pettersson et al., 1999]) son, en orden de importancia
decreciente, los patógenos que han sido más investigados para su posible uso
como bioplaguicidas.
Paenibacillus
popilliae es un patógeno del escarabajo japonés Popillia japonica Newman y de otros escarabajos del césped. Las
infecciones de este patógeno son llamadas “enfermedades lechosas” debido al
color blancuzco de la hemolinfa de los hospederos enfermos. A pesar de la
importancia de las plagas a controlar con este patógeno, P. popilliae ha fallado generalmente como bioplaguicida comercial
(aunque todavía está disponible comercialmente) porque no produce esporas
fácilmente cuando se cultiva en medios de fermentación (Lüthy, 1986).
La segunda especie, B. sphaericus, es de interés porque mata
larvas de mosquitos, tal como lo hace una subespecie de B. thuringiensis (B.t.
israelensis). Esta especie puede ser
producida por fermentación, su actividad insecticida se debe a las toxinas
cristalinas que son liberadas cuando el insecto digiere las esporas que ha
ingerido con su alimento. El rango de hospederos de esta bacteria está
limitado a unos pocos géneros de mosquitos. Los genes que codifican por la
toxina han sido identificados y transferidos a otras bacterias (Baumann [P.] et
al., 1987, Baumann [L.] et al., 1988; Baumann y Baumann, 1989). Los genes de B. sphaericus han sido usados para
producir organismos recombinantes que expresan toxinas de esta especie y de B. thuringiensis (Park et al., 2003,
2005). Bacillus sphaericus, ya sea
sola o en combinación con otros materiales, sigue siendo de interés para el
control de Culex spp. y de mosquitos
que se crían en agua contaminada. ESte patógeno parece tener un nicho potencial
como mosquitocida.
Bacillus thuringiensis es el patógeno bacteriano de artrópodos
más extensamente comercializado. Unos 50,000 aislamientos han sido colectados,
de los cuales 65 serotipos (basados en antígenos flagelares) han sido
reconocidos y recibido nombre a nivel de subespecies. La mayoría de estos
serotipos afectan larvas de lepidópteros, algunos como por ejemplo B. t. kurstaki han sido usados contra
varios lepidópteros plaga de frutas, hortalizas y bosques. La subespecie israelensis es efectiva contra larvas de
dípteros, incluyendo mosquitos, jejenes, moscas de las alcantarillas y
micetofílidos (de Barjac, 1978; van Essen y Hembree, 1980; Mulla et al., 1982).
La subespecie B. t. tenebrionis
infecta larvas de crisomélidos como el escarabajo de la papa Leptinotarsa
decemlineata (Say) (Herrnstadt et al., 1987). Los insectos que ingieren
esporas de B. thuringiensis mueren
por el efecto combinado del envenenamiento por toxinas y la multiplicación de
las bacterias. Los bioplaguicidas que contienen este patógeno son importantes
en agricultura orgánica y en manejo integrado de plagas, por su compatibilidad
con parasitoides y depredadores. El uso total, sin embargo, sigue siendo menor
al compararlo con los insecticidas convencionales en los cultivos (Whalon y
Wingerd, 2003).
Los genes Bt, sin embargo,
han sido usados para producir variedades de cultivos resistentes a plagas
(Vaeck et al., 1987) y su adopción por el productor ha sido extensa. En 2006,
aproximadamente el 50% de todo el algodón y del maíz sembrado en los Estados
Unidos fueron variedades Bt. Altas tasas de uso similares también ocurren en
algunos otros países (James, 2002; Shelton et al., 2002). Cuando las toxinas Bt
expresadas por la planta controlan plagas clave, el uso de plaguicidas
disminuye, permitiendo mucha mayor sobrevivencia de enemigos naturales en el
cultivo (Dively y Rose, 2003; Naranjo y Ellsworth, 2003). Es posible que se
presente resistencia a las toxinas Bt, liberadas como aspersión de
bioplaguicida o por plantas transgénicas (Tabashnik et al., 1990) y por tanto el
monitoreo y manejo para retrasar la resistencia son aspectos importantes del
uso de las toxinas de este patógeno. También se han originado problemas
sociales más amplios por el uso de los cultivos Bt (Gray, 2004).
Virus entomopatógenos
De las varias familias
de virus de insectos (Entwistle, 1983; Moore et al., 1987; Tanada y Kaya,
1993), sólo Baculoviridae (Granados y Federici, 1986) (con una excepción) es
importante como bioplaguicida o como causante de epizootias naturales. Los
baculovirus usualmente matan a sus hospederos y se sabe que sólo infectan insectos
(Payne, 1986). Esta familia contiene a los nucleopoliedrovirus (NPV por su
sigla en inglés) y a los granulovirus (GV por su sigla en inglés).
Un rol de los
baculovirus en el control biológico es que como patógenos naturales, causan
ciclos periódicos de enfermedad. Tales patógenos podrían ser especies nativas
locales o virus introducidos dirigidos a una especie invasora. Fuxa (1990)
enlistó 15 casos en que los baculovirus fueron introducidos y establecidos
exitosamente contra insectos plaga invasores.
Los baculovirus
también pueden ser formulados como bioplaguicidas. Sin embargo, debido a que
todos los virus son parásitos obligados, deben ser criados en insectos vivos o
en cultivos de células de insectos. Consecuentemente, pocos virus han tenido
éxito como productos comerciales porque los costos de producción son altos y el
uso del producto está limitado por una alta especificidad del hospedero. En la
ausencia de productos provechosos producidos por negocios privados, algunos
bioplaguicidas virales han sido producidos con fondos públicos. En Brasil, el
apoyo del gobierno condujo al desarrollo del virus de la nucleopoliedrosis del
defoliador de la soya Anticarsia
gemmatalis Hübner (Moscardi, 1983, 1999); este bioplaguicida ha sido
adoptado por algunos productores de soya (Corrêa-Ferreira et al., 2000).
Nemátodos que atacan a artrópodos
De las más de 30
familias de nemátodos, nueve tienen potencial para el control biológico de
insectos. Existen dos casos en los que los nemátodos introducidos han suprimido
un insecto invasor.
Casi todo el interés en nemátodos para control biológico de insectos ha
sido en la producción comercial de esteinernemátidos y heterorhabdítidos para
ser usados como bioplaguicidas (Gaugler y Kaya, 1990; Kaya, 1993; Grewal et
al., 2005; Adams et al., 2006). Estos nemátodos albergan bacterias simbióticas
aptas para matar rápidamente al hospedero (Kaya, 1985; Burnell y Stock, 2000).
STEINERNEMATIDAE Y
HETERORHABDITIDAE
Muchas especies de Steinernema y Heterorhabditis han sido
comercializadas como bioplaguicidas (Gaugler y Kaya, 1990; Kaya, 1993; Kaya y
Gaugler, 1993; Tanada y Kaya, 1993; Bullock et al., 1999; Koppenhöfer y Fuzy,
2003). Estas familias de nemátodos han sido usadas como agentes de control
comercial de plagas porque tienen los siguientes atributos (Poinar, 1986):
·
Amplio rango de hospederos
·
Habilidad para matar al hospedero en menos de 48 horas
·
Capacidad para crecer en medios artificiales
·
Un estado infeccioso durable capaz de ser almacenado
·
Carencia de resistencia del hospedero
·
Seguridad aparente para el ambiente
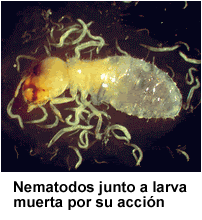 Estos nemátodos
invaden hospederos a través de aberturas naturales (boca, espiráculos, ano) o
hieren y penetran el hemocele. Bacterias de los géneros Xenorhabdus o Photorhabdus
son liberadas y matan rápidamente al hospedero. Entonces, los nemátodos se
desarrollan saprofíticamente en el cadáver. Ver Lewis et al. (2006) para una revisión
de la ecología y conducta de estos nemátodos, en relación con su uso en el control
de plagas, y a Grewal et al. (2006) para información sobre la quimorecepción de
los nemátodos y su biología en relación al calor y la sequía. Gaugler y Kaya
(1990) y Kaya y Gaugler (1993) proporcionan información sobre la cría de estos
nemátodos y su uso para control de plagas. Solamente son efectivos en ambientes
húmedos, tales como el suelo o follaje húmedo en climas tropicales. Las especies
de Heterorhabditidae hacen que los cadáveres hospederos cambien a rojo
brillante.Para algunas especies, se han establecido mercados comerciales y
desarrollado sistemas de producción a gran escala (Kaya, 1985; Gaugler y Kaya,
1990).
Estos nemátodos
invaden hospederos a través de aberturas naturales (boca, espiráculos, ano) o
hieren y penetran el hemocele. Bacterias de los géneros Xenorhabdus o Photorhabdus
son liberadas y matan rápidamente al hospedero. Entonces, los nemátodos se
desarrollan saprofíticamente en el cadáver. Ver Lewis et al. (2006) para una revisión
de la ecología y conducta de estos nemátodos, en relación con su uso en el control
de plagas, y a Grewal et al. (2006) para información sobre la quimorecepción de
los nemátodos y su biología en relación al calor y la sequía. Gaugler y Kaya
(1990) y Kaya y Gaugler (1993) proporcionan información sobre la cría de estos
nemátodos y su uso para control de plagas. Solamente son efectivos en ambientes
húmedos, tales como el suelo o follaje húmedo en climas tropicales. Las especies
de Heterorhabditidae hacen que los cadáveres hospederos cambien a rojo
brillante.Para algunas especies, se han establecido mercados comerciales y
desarrollado sistemas de producción a gran escala (Kaya, 1985; Gaugler y Kaya,
1990).